Síndrome de Williams
- O que é a patologia:
A Síndrome de Williams-Beuren é uma doença multissistêmica, devido a alteração estrutural do cromossomo 7, em que possui a deleção de aproximadamente 25 genes contíguos. Foi descrita em 1961, por Williams e, em 1962, por Beuren. Ambos observaram a presença de características faciais particulares como: olhos bem separados, bochechas cheias e pesadas, com bocas largas e má oclusão dentária39 (figura 1), associadas à estenose supravalvular da aorta, hipercalcemia infantil e deficiência intelectual (normalmente leve) em pacientes não aparentados.
Figura 1. Fisionomia de um portador de Síndrome de Williams.
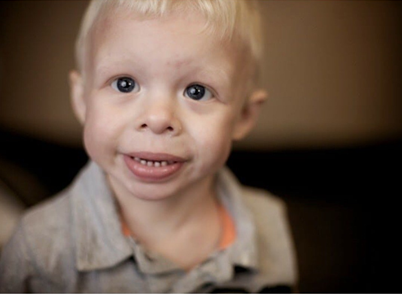
Fonte: Diário Chaco, 2018. Disponível no repositório digital da Wikimedia Commons.
A síndrome de Williams-Beuren (SWB) apresenta-se em indivíduos de qualquer etnia e sexo, possuindo frequência estimada entre 1:7500 e 1:20.000 nascidos vivos3, 35. Pode ser definida por diversas características físicas e de desenvolvimento fora do padrão de normalidade.
A variabilidade clínica nesta síndrome, muitas vezes pode atrasar e dificultar o diagnóstico clínico. A hipótese diagnóstica é realizada por características faciais e pela evolução clínica durante os primeiros anos de vida, uma vez que o perfil cognitivo também se torna mais evidente21.
- Base genética:
A Síndrome de Williams-Beuren afeta igualmente homens e mulheres e é uma das mais detectadas durante a infância. É frequentemente de origem "de novo" e afeta aproximadamente 1:7500 a 1:20.000 nascidos vivos. O termo "de novo" é usado para descrever esta síndrome como esporádica e de baixo risco de recorrência familiar. Raramente há uma história familiar, e quando ocorre, há 50% de chance dos pais transmitirem o distúrbio para seus descendentes. Já quando os pais não são afetados o risco da anomalia é geralmente baixo, mas ainda pode ocorrer pelo [1]mosaicismo de células germinativas.
A SWB é causada por alterações cromossômicas de caráter estrutural que geralmente são em larga escala, afetando a estrutura do cromossomo. Essas alterações podem ocorrer espontaneamente ou induzidas por agentes que causam a quebra do cromossomo. Tais alterações podem ocorrer como uma mutação desbalanceada, quando sofrem modificações na dosagem gênica de um segmento cromossômico e como uma mutação balanceada, em que irá ocorrer a troca na ordem dos genes no cromossomo. O tipo que ocorre na SWB é por desbalanceamento dos genes, nesse caso por deleção.
A SWB é causada pela 2deleção hemizigótica de aproximadamente 1,5 Mb a 1,8Mb de genes contíguos na região do braço longo do cromossomo 7. Essa deleção engloba aproximadamente 25 genes de cópias únicas, dentre os quais se destaca o gene da elastina[2] (figura 2).
Figura 2. Mapa físico da região cromossômica crítica da síndrome de Williams-Beuren (7q11.23) comumente excluída.
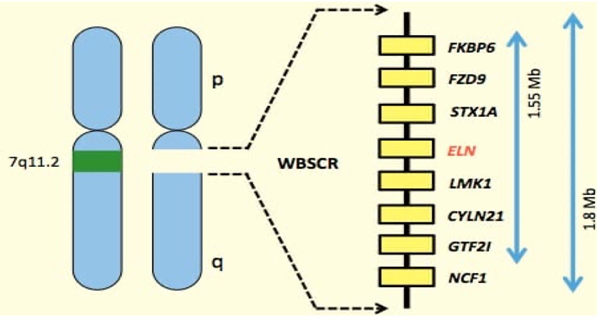
Fonte: Torres, 2017. Disponível no repositório digital da Wikimedia Commons.
Dentre todos os genes listados vale ressaltar o papel do gene da elastina (ELN). Mais de 95% dos indivíduos com SWB têm deleção ELN, detectável por hibridização in situ fluorescente (FISH).
Estudos demonstraram que o mecanismo de microdeleção está diretamente ligado a regiões repetitivas chamadas de repetições com baixo número de cópias, denominadas de LCRs (Low Copy Repeats), também chamadas de duplicações segmentais (SDs) e apresentam entre 10 a 400 Kb de tamanho. 33 Estas regiões com alta incidência de repetitividade estão distribuídas ao longo do genoma e compreendem cerca de 5% de seu total.22
As LCR’s atuam durante o processo meiótico, uma vez que estão diretamente ligadas aos eventos de recombinação cromossômica. Alguns destes processos de recombinação, por sua vez, podem acontecer de forma desigual entre homólogos não alélicos (nonallelic homologous recombination-NAHR), o que resulta na duplicação, inversão ou deleção de um ou mais genes.22
As LCRs estão divididas em 3 blocos: A, B e C; que estão organizados em segmentos centromérico, medial e telomérico, e representam o substrato para a ocorrência de crossing over durante a divisão meiótica.19, 22 As LCRs são compostas tanto por genes quanto por pseudogenes15 e possuem uma alta similaridade de sequências homólogas o que leva à predisposição para a ocorrência de um pareamento não homólogo entre blocos diferentes (non allelic homologous recombination - NAHR).4
Em indivíduos com SWB a deleção mais comum possui pontos de quebra nos blocos de LCRs B medial e B central, com o tamanho aproximado de 1.5 Mb. Há ainda descrições de deleções atípicas de maior ou menor tamanho. 5, 31 Por volta de 5% dos indivíduos que apresentam esta síndrome possuem deleções com medida de aproximadamente 1,84 Mb. Este tipo de deleção, por sua vez, tem sua origem pela recombinação entre os blocos de LCRs A centromérica e A medial.27, 37
As deleções atípicas são aquelas menores ou maiores que as deleções típicas, os pacientes portadores dessas deleções apresentam na maioria dos casos apenas algumas características do perfil clínico típico da SWB, como faciais típicas, cardiopatias congênitas e perfil cognitivo. Portanto, a identificação de pacientes com as deleções atípicas é de grande relevância, pois fornece informações para a correlação genótipo-fenótipo da SWB9. As deleções atípicas podem ser detectadas por técnicas como MLPA (Multiplex ligation-dependent probe amplification), qPCR (quantitative real-time PCR). Deleções parciais que abrangem região telomérica da SWB distal ao gene da ELN são mais graves do que as deleções que englobam a parte centromérica ao gene da ELN. 16, 17, 20, 38, NGS (New generation sequencing) e a CGH.34, 40
As [3]inversões paracêntricas, no lócus da SWB são devido a quebras externas da região de cópia única do gene, sem interrupção da expressão gênica, sem sintomas clínicos e presente em 30% das transmissões cromossômicas parentais da população de pacientes com SWB.5, 26 Na população que não possui a SWB, a presença da inversão está presente em cerca de 5%.
- Parte biológica:
A SWB é causada por uma alteração estrutural do cromossomo 7 que abrange cerca de 25 genes na região cromossômica 7q11.23. Ocasionalmente, observa-se a transmissão para os filhos, porém grande quantidade de casos são originados de mutações esporádicas.6
A deleção de genes na SWB tem por consequência a falta de proteínas, isso acarretará em diversas características fenotípicas e comportamentais nos portadores da síndrome. A seguir serão apresentados os 25 genes localizados na região 7q11.23 da SWB, com seus respectivos nomes, função e correlações fenotípicas (Tabela 1).
Tabela 1 - Genes localizados na região 7q11.23 com seus respectivos nomes, função e correlações fenotípicas
|
Gene |
Função da proteína |
Fenótipo |
|
ABHD11 |
Domínio α-β hidrólise. Função pouco conhecida. |
Relação desconhecida. |
|
BAZ1B |
É um componente do complexo WINAC remodelador de cromatina ATP-dependente. Controle transcricional da vitamina D. |
Alterações metabólicas que incluem a síntese de vitamina D e a hipercalcemia. |
|
BCL7B |
Membro da família de proteínas BCL 7. Função ainda desconhecida. |
Relação desconhecida. |
|
CLDN3 |
Proteína componente de junções de fita “tight” em células epiteliais do fígado. Atua na manutenção da polaridade celular. |
Relação desconhecida. |
|
CLDN4 |
Proteína componente de junções de fita “tight” em células epiteliais do rim. Atua na manutenção da polaridade celular. |
Relação desconhecida. |
|
CLIP2 |
Proteína de ligação citoplasmática. Atua na regulação da dinâmica de microtúbulos. |
Características faciais, junto aos genes GTF2IRD1 e também prejuízos motores. |
|
DNAJC30 |
Domínio DnaJ envolvido no dobramento de proteínas. |
Relação desconhecida. |
|
EIF4H |
Proteína contém um motif de reconhecimento de RNA. Atua no início da síntese proteica. |
Relação desconhecida. |
|
ELN |
Proteína estrutural, componente de fibras elásticas. Atua na morfogênese arterial. |
Cardiopatia, característica vocal rouca, envelhecimento precoce, divertículos vesicais, hérnias, frouxidão das articulações. |
|
FKBP6 |
Proteína imunofilina. Atua na fertilidade masculina e pareamento de cromossomos homólogos na meiose. |
Esterilidade masculina, aspermia, alterações morfológicas no espermatozóide. Relação desconhecida com o fenótipo da SWB. |
|
FZD9 |
Proteínas que atuam como receptores para proteínas sinalizadoras Wnt. Pode estar envolvida na polaridade e desenvolvimento tecidual. |
Expressão predominantemente no cérebro, testículo, olhos, musculatura esquelética e rins. Alteração neuroanatômica no hipocampo (ratos), alteração visoespacial, memória e aprendizagem. Sua relação com o fenótipo da SWB ainda não está clara |
|
GTF2IRD1 |
Membro da família de fatores de transcrição GTF2I com zipper-leucina e cinco repetições-I. Pode atuar na ativação/supressão da transcrição gênica. |
Prejuízo motor, características faciais típicas e prejuízo visoconstrutivo típico da SWB, juntamente com a deleção do gene GTF2I. Deleção parcial não leva ao perfil cognitivo típico da SWB. |
|
LAT2 |
Regulação da ativação de mastócitos. Função pouco conhecida. |
Relação desconhecida. |
|
LIMK1 |
Serina/treonina quinase com domínios LIM. Atua na modelação do citoesqueleto de actina essencial à migração neuronal. |
Prejuízo visoconstrutivo.11 Função ainda questionada. Estudo de Schimitt et al. (2001) sugeriu participação nas alterações morfológicas do corpo caloso na SWB. |
|
MLXIPL |
Fator de transcrição da glicose que juntamente com outros genes está envolvido na lipogênese hepática. |
Relação desconhecida. |
|
NSUN5 |
Proteína com um domínio NOL1/NOP2/sun. Pode atuar na regulação do ciclo celular. |
Relação desconhecida. |
|
POM121 |
Componente do complexo de poros nucleares que controla o tráfego bidirecional macromolecular em células. |
Relação desconhecida. |
|
RFC2 |
Componente do complexo de replicação do fator C, o qual é um ativador de DNA polimerase durante a replicação. |
Fator de crescimento neuronal. Sugeres e relação com prejuízos neurodesenvolvimentais. Relação pouco conhecida com o fenótipo da SWB. |
|
STX1A |
Proteína sintaxina 1A, desempenha papel chave no transporte intracelular e liberação de neurotransmissor. |
Característica facial típica junto ao gene GTF2I14. |
|
TBL2 |
Proteína β-transducina com quatro repetições prováveis WD40. Pode atuar em vias de sinalização intracelular ou organização do citoesqueleto. |
Relação desconhecida com o fenótipo da SWB. Há relato de que a proteína transducina atua como supressor tumoral. |
|
VPS37D |
Tráfego celular e complexo endossômico. |
Relação desconhecida. |
|
WBSCR22 |
Proteína com motif de ligação S- adenosil-L-metionina. Pode estar envolvida com metilação do DNA. |
Relação desconhecida. |
|
WBSCR23 |
Desconhecida. |
Relação desconhecida. |
|
WBSCR27 |
Função desconhecida. |
Relação desconhecida. |
|
WBSCR28 |
Função desconhecida. |
Relação desconhecida. |
Fonte: ROSSI, N. F.; MORETTI-FERREIRA. Caracterização do fenótipo comportamental e de linguagem na síndrome de Williams-Beuren. (2010, p. 27).
O gene Elastina (ELN) é o único gene bem caracterizado quanto a sua correlação genótipo-fenótipo na SWB, sendo que pouco se sabe à respeito da deleção dos demais genes sobre fenótipo da SWB, principalmente, em relação ao fenótipo neurocognitivo30.
A codificação da elastina, é um exemplo das complicações desta doença, pois esta encontra-se prejudicada, uma vez que a região cromossômica deletada na SWB envolve esse gene. ELN configura-se como importante componente das fibras elásticas do tecido conjuntivo e a haploinsuficiência do mesmo apresenta correlação a várias características marcantes encontradas na SWB, como as cardiopatias congênitas, alterações faciais, voz rouca, envelhecimento precoce, hérnias e contraturas ou frouxidão das articulações (Tabela 2).
Tabela 2 - Manifestações clínicas gerais de indivíduos com SWB
|
Intercorrências do Nascimento e da Infância
|
Atraso no desenvolvimento neuropsicomotor
|
Baixo peso ao nascimento
Dificuldades no ganho de peso
|
Baixa estatura
Hipercalcemia |
Otites de repetição |
Constipação intestinal
|
Hérnia umbilical/ inguinal |
|
Características Faciais |
Proeminência supraorbitária
|
Bochechas proeminentes(figura 3) |
Ponte nasal baixa (figura 3)
Narinas antevertidas (figura 3)
Filtro nasal longo (figura 3)
|
Macrostomia
|
Anomalias dentárias (figura 4) |
Orelhas grandes e em abano (figura 3) |
|
Características Cardiovasculares |
Alterações cardíacas (estenose aórtica supravalvar e estenose da artéria pulmonar)
|
Hipertensão sistêmica
|
|
|
|
|
|
Características Oftalmológicas |
Estrabismo |
Íris estrelada (figura 5)
|
|
|
|
|
|
Características Musculoesqueléticas
|
Clinodactilia do 5º dedo |
Alterações Renais |
|
|
|
|
|
Característica de Personalidade, Cognição, Linguagem e Audição |
Deficiência mental |
Personalidade amigável |
Ansiedade |
Hiperatividade
|
Característica vocal rouca e áspera |
|
Fonte: Borg et al. 1995; Kotzot et al. 1995; Lowery et al. 1995; Nickerson et al. 1995; Joyce et al. 1996; Perez-Jurado et al. 1996; Elçoglu et al. 1998; Beust et al. 2000; Mila et al. 2000; Sugayama 2001; Souza 2003.
Figura 3. Características faciais em um bebê com síndrome de Williams.
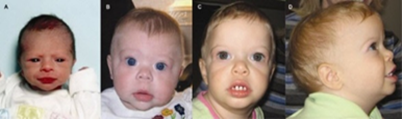
Fonte: Morris CA. Williams Syndrome. 1999 Apr 9 [Updated 2017 Mar 23]. In: Adam MP, Ardinger HH, Pagon RA, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2020. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1249/
Figura 4. Visão intraoral de um portador da Síndrome de Williams.
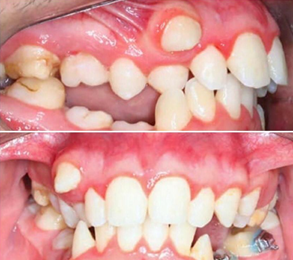
Fonte: Ribeiro et al 2018. Disponível no repositório digital da Wikimedia Commons.
Figura 5. Íris estrelada, característica oftalmológica da síndrome de Williams.
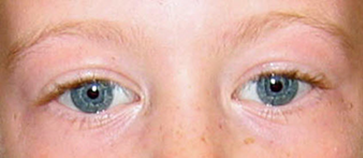
Fonte: Morris CA. Williams Syndrome. 1999 Apr 9 [Updated 2017 Mar 23]. In: Adam MP, Ardinger HH, Pagon RA, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2020. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1249/
As outras características clínicas da síndrome, como o perfil cognitivo típico tem sido associado à haploinsuficiência de outros genes presentes na região, como LIMK1, GTF2IRD1 e GTF2I, pelos estudos envolvendo pacientes com deleções atípicas, que são deleções maiores ou menores que 1.5 Mb e 1.8 Mb.3, 9, 10, 14, 24
O fenótipo comportamental da SWB é marcado pela facilidade de interação social, desinibição, impulsividade, além da atração por pessoas desconhecidas, ainda tem sido marcado por traços opostos de sociabilidade, uma vez que esses indivíduos são mais susceptíveis às situações sociais, mas que, no entanto falham no seguimento de regras sociais, incluindo o desrespeito às regras convencionais30.
A sociabilidade desses indivíduos, é apontada como uma característica ambígua, uma vez que de acordo com o julgamento dos pais esta facilidade para interagirem com estranhos e de preferência com idade superior a deles representa uma preocupação social. Entretanto, os próprios pais consideram que o comportamento extrovertido e amigável dos seus filhos são pontos positivos por facilitarem a interação social dos mesmos30.
Dentre os comportamentos citados pelos autores incluem-se: hábito de destruir objetos; morder outras crianças; desobediência; obstinação; ansiedade; inquietação; dificuldade para permanecer sentado; hiperatividade; fala excessiva; hiperacusia; dificuldades para dormir; dificuldades para comer; enurese; desinibição com estranhos; hábito de seguir estranhos; mentira; e, vergonha. Além da fobia e ansiedade que são sintomas frequentemente descritos como parte do fenótipo comportamental da SWB30.
A SWB foi reconhecida na literatura mundial pelo intrigante funcionamento neurocognitivo, por apresentar características que sugerem a dissociação entre os domínios cognitivos verbais e não-verbais, denominado “Williams Syndrome Cognitive Profile”. Esse fenótipo neurocognitivo inclui também a facilidade para habilidades musicais e para o reconhecimento facial. A característica de fala fluente, bem articulada e gramaticalmente correta, contrastando com prejuízos cognitivos, compuseram as primeiras e principais descrições sobre o fenótipo comportamental da SWB30.
Entretanto, estudos mais específicos sobre o processamento visual da informação em indivíduos com a SWB mostraram que a dificuldade desses indivíduos está na capacidade de integração dos estímulos visuais, de modo que o processamento da informação visual não se faz por completo. Segundo os autores, o processamento visual dos indivíduos com a SWB se atém à fase de análise dos detalhes da imagem e não segue para a etapa seguinte, em que o cérebro realiza a integração visual a fim de gerar uma representação global. Essa dificuldade integrativa ocorre preferencialmente mediante tarefas que requerem rotação e julgamento espacial, mas que estão prejudicadas em ambas as fases.30
- Diagnóstico:
A análise cromossômica e o teste FISH da região do cromossomo da síndrome de Williams são recomendados para confirmação do diagnóstico já que pela citogenética clássica é impossível ser visualizada a deleção submicroscópica 7q11.23.33
A existência de um rearranjo genômico em 7q11.23 em alguns dos progenitores é capaz de ocasionar a SWB nas próximas gerações. A análise por FISH demonstrou que aproximadamente 33% dos progenitores são heterozigotos para uma inversão paracêntrica, estimada em 1,5 Mb. Tal inversão abrange a Região cromossômica da Síndrome de Williams-Beuren (WBSCR).26
A técnica FISH utiliza uma sonda com a sequência de DNA do gene da ELN marcada com fluorocromo que se liga especificamente à região cromossômica, detectando a presença ou ausência da região comprometida na SWB, em células metafásicas e nos núcleos interfásicos. No entanto, um resultado FISH negativo não deve descartar a síndrome de Williams. A avaliação dos sinais clínicos e o uso de técnicas moleculares mais específicas para a identificação de outros genes envolvidos também deve ser levado em consideração quando estabelecer o diagnóstico. No Brasil, o uso do FISH tem sido divulgado, como recurso diagnóstico associado ao estudo das características clínicas da SWB, com o objetivo de estabelecer parâmetros para a solicitação deste exame para o geneticista.33, 29
- Papel da fisioterapia em pacientes com a patologia:
Observa-se nas crianças portadoras da síndrome uma série de características decorrentes de desordem genética, dentre estas estão a hipotonia muscular no primeiro ano de vida, que leva ao atraso no desenvolvimento motor e prejudica a deambulação, limitações articulares e desordens de equilíbrio e propriocepção por alterações no canal auditivo. Sem tratamento adequado essas crianças desenvolvem atrasos motores que levam a limitações funcionais, para evitar esses déficits o profissional fisioterapeuta é essencial.12, 36
O tratamento deve ser iniciado o mais precocemente possível, essa acaba sendo uma dificuldade já que o diagnóstico da síndrome de williams ocorre de forma tardia, já quando a criança apresenta desenvolvimento atípico. Esse desenvolvimento é pontuado geralmente por dificuldade de controle cervical e tronco, dificuldade de transferência de prono para supino (rolar), dificuldade motora fina (manipular objetos) decorrente de limitação de supinação, dificuldade em manter-se sentado, começar engatinhar e de deambulação, tudo isso decorrente da hipotonia muscular; a criança também apresenta alterações neurosensoriais (déficit de equilíbrio e sensitivo) decorrente de alterações na tuba auditiva, sendo que todos estes déficits citados tendem a piorar com a idade. O trabalho do fisioterapeuta tem como objetivo impedir o desenvolvimento dessas alterações utilizando a intervenção precoce, ou diminuir e refrear as já desenvolvidas, possibilitando assim um desenvolvimento típico a idade.2, 32
Para atingir tal objetivo o fisioterapeuta utiliza diversas técnicas neuromotoras, sendo o ideal iniciar a intervenção precoce, esta tem por objetivo prevenir as deficiências nas estruturas e funções do corpo otimizando o desenvolvimentos do lactente na tentativa de evitar as limitações, devem ser realizadas antes de se detectar as atipicidade no desenvolvimento, antes que as manifestações clínicas próprias das afecções estejam evidentes nas estruturas e funções do corpo. Essa técnica estimula movimentos do lactante por meio de estímulos do ambiente como estímulos táteis (reflexo de busca e marcha), estímulos visuais (luz/escuridão, cores, tamanhos e distâncias diferentes) e estímulos auditivos (sons agudos, conversar com o bebê e objetos musicais).7, 28
Na impossibilidade de intervenção antes do desenvolvimento de limitações, as técnicas da intervenção precoce são adaptadas e passam a ser associadas a outras técnicas de tratamento como o Bobath, técnica muito utilizada em pacientes com atraso motor de desenvolvimento, e consiste em um treino estimulante respeitando as etapas de desenvolvimento típicas. Essa técnica possibilita a inibição dos padrões reflexos anormais e a facilitação dos movimentos normais por meio de estimulação, com objetivo de normalizar os padrões, é uma abordagem terapêutica que prioriza a correção de problemas posturais e movimento e a independência funcional dos indivíduos. Outro tratamento também pautado no estímulo neuromotor, por facilitação e inibição, com objetivo de normalizar os padrões de movimento é o Pediasuit, que estimula as posturas e movimentos da criança por meio do uso de vestes que mantém a postura e possibilita a intensidade do treino e participação motora ativa dos pacientes.1, 13, 18
Por apresentar dificuldade de deglutição, na amamentação, e posteriormente de desenvolvimento da fala, o tratamento com um fonoaudiólogo também é essencial, e primordial que ocorra precocemente, ou seja, ainda no período de lactação. Tratamento com nutricionista é outro geralmente necessário, pois as crianças apresentam dificuldade de ganho de peso na primeira infância e propensão à obesidade a partir da puberdade, sendo necessária orientação nutricional.
Como não existe nenhum tratamento genético intra uterino ou após o nascimento, e também nenhum outro tratamento específico para esta síndrome, os tratamentos são baseados no aparecimento de sintomas, se estes surgem são tratados por especialistas. Como é recorrente problemas cardíacos, renais, metabólicos, no canal auditivo e odontológicos o acompanhamento com os médicos especialistas dessas áreas (cardiologista, urologista ou nefrologista, nutricionista e endócrino, otorrinolaringologista e dentista) é usual, como forma de prevenção e controle. Os sintomas são variáveis entre portadores, assim sendo o tratamento com os especialistas não é definido, indo desde acompanhamento com tratamento medicamentoso a intervenções cirúrgicas, é individualizado e inteiramente dependente da sintomatologia apresentada.12, 18, 28, 32
- Curiosidades
No dia 7 de novembro é comemorado o dia da conscientização e luta da Síndrome de Williams.
Existe uma Associação Brasileira da Síndrome de Williams que tem como um dos objetivos estudar mais aspectos dos portadores da SWB, é através dele que muitas famílias recebem assistência como, por exemplo, a entrega de cestas básicas que é realizada por esta instituição. No site encontramos várias informações sobre a SWB, profissionais que participam do tratamento multidisciplinar, filmes que abordam a patologia e até mesmo relatos de pais que possuem filhos com a síndrome. Para mais informações e como contribuir com este projeto o link da Associação Brasileira da Síndrome de Williams é: http://swbrasil.org.br/
- Produto produzido sobre a Síndrome de Williams:
Animação com informações sobre a Síndrome de Williams.
8. Equipe:





Camila M. Thayna Soares Fernanda O. Lorena Caligiuri Lemes Francyelle de Souza
de Jesus de Melo Casoni Leite
- Referências Bibliográficas
- ALMEIDA K. M., FONSECA S. T., FIGUEIREDO P. R.P., AQUINO A. A., MANCINI M. C. Effects of interventions with therapeutic suits (clothing) on impairments and functional limitations of children with cerebral palsy: a systematic review. Brazilian Journal of Physical Therapy, Volume 21; 307-320, 2017.
- ALMEIDA, M. M.; FORMIGA, C. K. M. R. Avaliação da motricidade ampla e fina na Síndrome de Williams: relato de caso. Motriz: rev. educ. fis. (Online) , Rio Claro, v. 16, n. 4, pág. 913-919, dezembro de 2010
- AMERICAN ACADEMY OF PEDIATRICS. Health care supervision for children with Williams syndrome. Pediatrics, v.107, p. 1192-1204, 2001.
- BATISTA, L. C. Avaliação de perdas e ganhos de DNA na região 7q11.23 em indivíduos com diagnóstico clínico de síndrome de Williams-Beuren e FISH negativo, 2019.
- BAYÉS, M. et al. Mutational mechanisms of Williams-Beuren syndrome deletions. Am. J. Hum. Genet., v. 73, p. 131-151, 2003
- BORG, I.; DELHANTY, J. D. A.; BARAITSER, M. Detection of hemizygosity at the elastin locus by FISH analysis as a diagnostic test in both classical and atypical cases of Williams syndrome. J. Med. Genet., London, v. 32, n. 9, p. 692-696, sept. 1995.
- BRITO, C. M. L. et al . Desenvolvimento neuropsicomotor: o teste de Denver na triagem dos atrasos cognitivos e neuromotores de pré-escolares. Cad. Saúde Pública, Rio de Janeiro , v. 27, n. 7, p.1403-1414, July 2011
- COPES, L.E.; POBER, B.R.; TERILLI, C. A.; KENNEDY, R. F. Description of Common Musculoskeletal Findings in Williams Syndrome and Implications for Therapies: Review. Wiley Periodicals, Inc, 2016.
- DELGADO, L. M. et al. A 1.3-Mb 7q11.23 atypical deletion identified in a cohort of patients with williams-beuren syndrome. Molecular Syndromology, v. 4, n. 3, p. 143–147, 2013
- EWART, A.K. et al. Hemizygosity at the elastin locus in an developmental disorder, Williams Syndrome. Nat. Genet., v. 5, p. 11-16, 1993.
- FRAGISKAKIS, J.M. et al. LIM-Kinase1 hemizygosity implicated in impaired visuospatial construct cognition. Cell, v. 86, p. 1-20, 1996.
- GESTÃO, M. G., SILVA, J. N. G., LAMÔNICA, D. A. C., DE-VITTO, L. P. M., ABRAMIDES, D. V. M., COSTA, A. R. Evolução das habilidades comunicativas na Síndrome de Williams – Processo terapêutico de um caso clínico. Revista Sociedade Brasileira de Fonoaudiologia, vol. 19, n. 2, p. 203-211, agosto. 2007
- GRAHAM, J. V., EUSTACE, C., BROCK, K., SWAIN, E., & I-C, S. (2009). The Bobath concept in contemporary clinical practice. Topics in stroke rehabilitation, 16(1), 57-68.
- HIROTA, H. et al. Williams syndrome deficits in visual spatial processing linked to GTF2IRD1 and GTF2I on chromosome 7q11.23. Genetics in Medicine, v. 5, n. 4, p. 311–321, 2003
- HOBART et al. Inversion of the Williams syndrome region is a common polymorphism found more frequently in parents of children with Williams syndrome. Am J. Med. Genet. C Semin. Med. Genet., v. 154C, p. 220-228, 2010.
- HONJO, R. S. et al. Williams-beuren syndrome: A clinical study of 55 Brazilian patients and the diagnostic use of MLPA. BioMed Research International, v, 2015.
- HOWALD, C. et al. Two high throughput technologies to detect segmental aneuploidies identify new Williams-Beuren syndrome patients with atypical deletions. J. Med. Genet., v. 43, p. 266-273, 2006.
- HOWLE, J. M. Neuro-developmental treatment approach: Theoretical foundations and principles of clinical practice. Neuro Developmental Treatment. 2002
- INOUE |K., LUPSKI, J. R. Molecular Mechanisms for Genomic Disorders. Annu Rev Genomics Hum Genet 3:199-242, 2002.
- LAURITO, S. et al. Detection of a Williams Beuren syndrome case by MLPA. Medicina, v. 73, n. 1, p. 47–50, 2013
- LOWERY, M.C. et al. Strong correlation of elastin deletions, detected by FISH, with Williams Syndrome: evaluation of 235 patients. Am. J. Hum. Genet., v. 57, p. 49-53, 1995.
- LUPSKY, J.R.Genomic disorders: Structural features of the genome can lead to DNA rearrangements and human disease traits. Trends in Genet 14:417-422, 1998.
- MORRIS CA. Williams Syndrome. 1999 Apr 9 [Updated 2017 Mar 23]. In: Adam MP, Ardinger HH, Pagon RA, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2020. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1249/
- MORRIS, C.A. et al. GTF2I hemizygosity implicated in mental retardation in Williams syndrome: genotype-phenotype analysis of five families with deletions in the Williams syndrome region. Am. J. Med. Genet. A, v. 1, p. 45-59, 2003.
- OLIVEIRA, F. R. B. Caracterização genético/clínica de pacientes com suspeita da síndrome de Williams-Beuren (SWB) no centro- oeste brasileiro.Dissertação (Mestrado em Ciências Biológicas) - Universidade Federal de Goiás,Goiania 96 f. 2019.
- OSBORNE, L.R. et al. A 1.5 million-base pair inversion polymorphism in families with Williams-Beuren syndrome. Nat. Genet., v. 29, p. 321-325, 2001
- PEOPLES, R.J.et al. A physical map, including a BAC/PAC clone contig, of the Williams- Beuren syndrome deletion region at 7q11.23. Am. J. Hum. Genet., v. 66, p. 47-68, 2000.
- PILZ E. M, SCHERMANN L.B .Determinantes biológicos e ambientais do desenvolvimento neuropsicomotor em uma amostra de crianças de Canoas/RS. Cien Saude Coletiva. 2007;12:181-90.
- ROSSI, N. F.; MORETTI-FERREIRA, D.; GIACHETI, C. M. Genética e linguagem na síndrome de Williams-Beuren: uma condição neuro-cognitiva peculiar. Pró Fono Revista de Atualização Científica, Barueri (SP), v. 18, n. 3, p.331-338, set. Dez. 2006
- ROSSI, N. F.; MORETTI-FERREIRA. Caracterização do fenótipo comportamental e de linguagem na síndrome de Williams-Beuren. 2010
- SCHUBERT, C. The genomic basis of the Williams-Beuren syndrome. Cell Mol. Life Sci., v. 66, p. 1178-1197, 2009.
- SILVA, L. A. F. KIM, C. A. MATAS, Carla Gentile. Características da avaliação auditiva na síndrome de Williams: revisão sistemática. CoDAS, São Paulo , v. 30, n. 5, e20170267, 2018
- SOUZA, D. H. A síndrome de Williams-Beuren: contribuições à avaliação clínica e genômica, 2013
- STREAȚĂ, I. et al. Array CGH - A Powerful Tool in Molecular Diagnostic of Pathogenic Microdeletions - Williams-Beuren Syndrome - A Case Report. Current health sciences journal, v. 42, n. 2, p. 207–212, 2016.
- STROMME, P.; BJORNSTAD, P.G.; RAMSTAD, K. Prevalence estimation of Williams syndrome. J. Child. Neurol., v. 7, p. 269-271, 2002
- SUGAYAMA, S. M. M. Estudo genético-clínico e citogenética molecular pela técnica da hibridação in situ por fluorescência (FISH) em pacientes com síndrome de Williams-Beuren. Tese (Doutorado em Pediatria) - Faculdade de Medicina, Universidade de São Paulo, São Paulo. 2001
- VALERO, M.C. et al. Fine-scale comparative mapping of the human 7q11.23 region and the orthologous region on mouse chromosome 5G: the low-copy repeats that flank the Williams-Beuren syndrome deletion arose at breakpoint sites of an evolutionary inversion(s). Genomics, v. 69, p. 1-13, 2000.
- VAN HAGEN, J. M. et al. Contribution of CYLN2 and GTF2IRD1 to neurological and cognitive. 2007
- WILLIAMS, J. C.; BARRATT-BOYES, B. G.; LOWE, J. B. Supravalvular aortic stenosis. Circulation., Hagerstown, v. 24, n. 6, p. 1311-1318, dec. 1961.
- YAGIHASHI, T. et al. Clinical utility of an array comparative genomic hybridization analysis for Williams syndrome. Congenital Anomalies,
Figura 1 - Fisionomia de um portador da Sindrome de Williams https://commons.wikimedia.org/wiki/File:Figura_1-_Fisionomia_de_um_portador_da_S%C3%ADndrome_de_Williams.jpg
Figura 2 - https://commons.wikimedia.org/wiki/File:Figura_2-_Representa%C3%A7%C3%A3o_do_cromossomo_7_defeituoso_.jpg
Figura 3 - Morris CA. Williams Syndrome. 1999 Apr 9 [Updated 2017 Mar 23]. In: Adam MP, Ardinger HH, Pagon RA, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2020. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1249/
Figura 4 - Morris CA. Williams Syndrome. 1999 Apr 9 [Updated 2017 Mar 23]. In: Adam MP, Ardinger HH, Pagon RA, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2020. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1249/
Figura 5 - Visão intraoral de um portador da Síndrome de Williams. https://commons.m.wikimedia.org/wiki/File:Figura_3-_Vis%C3%A3o_intraoral_de_um_portador_da_S%C3%ADndrome_de_Williams.jpg
