Síndrome de Leigh
- O que é a patologia?
A síndrome de Leigh, doença neurodegenerativa severa e progressiva, foi descrita por Denis Leigh, em 1951, como uma patologia rara que faz parte do grupo das encefalopatias (Quadro 1) mitocondriais1.
O metabolismo energético do portador é afetado através da alteração do processo de fosforilação oxidativa, causando um déficit na produção de Adenosina Trifosfato (ATP) celular1. Dessa forma, qualquer sistema pode ser acometido, resultando, por exemplo, em alterações endócrinas, cardíacas e gastrointestinais. É importante destacar que o sistema nervoso é o mais afetado, pois é um dos sistemas que mais necessitam de energia (ATP) para seu bom funcionamento, o déficit de ATP acaba ocasionando fraqueza muscular, atraso do desenvolvimento psicomotor, alterações oftalmológicas, problemas respiratórios, entre outros1 ,2.
Taxa de Ocorrência Populacional e Diferentes Etnias:
A taxa de incidência na população, de forma geral, é de 1 para 4.0000 nascidos vivos. Entretanto, em algumas regiões, esse número pode variar muito. Na região de Saguenay Lac-Saint-Jean, no Quebec, a taxa é de aproximadamente 1 para 2000. Enquanto nas Ilhas Faroe a taxa é de 1 para 1700 nascidos vivos1 .
- Parte biológica:
A Síndrome de Leigh, apesar de ser uma doença rara, é a síndrome de alteração mitocondrial mais comum no primeiro ano de vida ². É uma patologia que pode se manifestar em bebês e crianças, geralmente entre 3 e 12 meses de idade, sendo também possível se expressar em adultos jovens1. Seu avanço e morte geralmente ocorre em cerca de 2 anos3.
Para entender um pouco mais essa síndrome, é necessário analisar, de forma geral, as funções e características mitocondriais. A mitocôndria (Figura 1) é uma organela membranosa encontrada em quase todas as células eucarióticas. Ela possui seu próprio material genético, duas membranas, uma interna e outra externa com um espaço intermembranoso entre elas, e a matriz mitocondrial que é delimitada pela membrana interna. Essa organela é a principal responsável pela produção de energia celular, na forma de ATP, usando açúcares, proteínas e gorduras obtidos, principalmente, através da alimentação. É por isso que alterações no material genético das mitocôndrias podem significar o acometimento de vários sistemas do corpo humano (Figura 2), uma vez que todos eles necessitam de energia em forma de ATP para um bom funcionamento13.
Figura 1 - Mitocôndrias
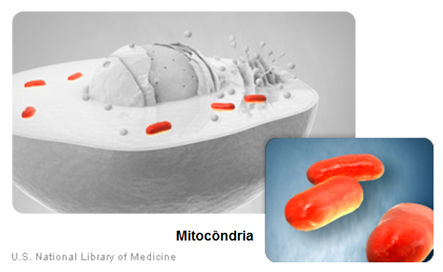
Fonte: U.S. National Library of Medicine14 editado por Carolina Angélico
Figura 2. Regiões que requerem maior gasto energético em humanos
Fonte: Pfeffer G. Chinnery PF18 editado por Isabela Assunção
A mitocôndria é responsável pelo o que chamamos de respiração aeróbica celular que é aquela em que há uso do oxigênio disponível. Esse processo de respiração pode ser dividido em três partes: glicólise, Ciclo de Krebs e cadeia respiratória. Como resultado da respiração, obtemos moléculas de ATP (que são fonte de energia)10.
Sintomas:
O início dos sintomas ocorre inesperadamente, mas, em alguns casos, apresenta alguns sinais, como a febre, por exemplo. As manifestações clínicas da síndrome podem incluir 1, 2, 3:
- Perda do controle da cabeça em crianças menores de um ano;
- Convulsões;
- Atraso motor;
- Dificuldade na marcha;
- Declínio cognitivo;
- Ataxia: incapacidade de coordenação, principalmente dos movimentos voluntários;
- Hipotonia: diminuição do tônus muscular;
- Distonia: contração involuntária contínua, podendo acontecer contração simultânea dos músculos agonistas e antagonistas;
- Anormalidades respiratórias com risco de hiperventilação ou apneia;
- Disfunções gastrointestinais como diarreia, vômitos, dificuldade de sugar, disfunções na deglutição, entre outros;
- Alterações oftalmológicas: oftalmoplegia (paralisia de um ou mais músculos oculares), nistagmo (movimento rítmico involuntário dos olhos), atrofia óptica (alterando o número de fibras nervosas ópticas que funcionam), estrabismo (desalinhamento entre os dois olhos).
- A Genética da Síndrome de Leigh:
A síndrome de Leigh (SL) é reconhecida como a doença mitocondrial mais comum na infância. Apresenta grande heterogeneidade (Quadro 1) do ponto de vista genético, por, atualmente, existirem relatos de mutações em mais de 50 genes responsáveis por causar a doença. Ela pode ser causada por mutações tanto no DNA nuclear como no DNA mitocondrial e, assim, diferentes formas de herança podem estar envolvidas: mendeliana (autossômica recessiva ou ligada ao cromossomo X) e mitocondrial (Figuras 3, 4 e 5). As mutações podem estar tanto no DNA mitocondrial, quanto no DNA nuclear (ou seja, nos cromossomos herdados dos pais), mas elas sempre resultarão em alterações na mitocôndria, independentemente de onde estiverem.
Figura 3 - Herança Autossômica Recessiva
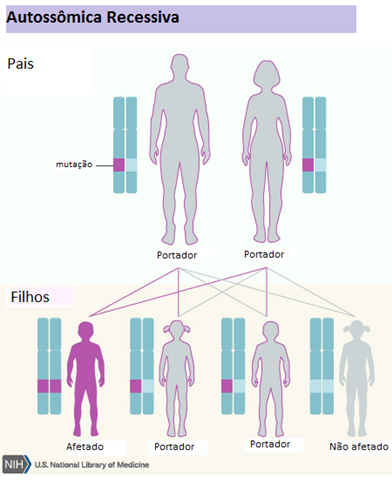
Fonte: U.S. National Library of Medicine15 editado por Carolina Angélico
Figura 4 - Herança Mitocondrial
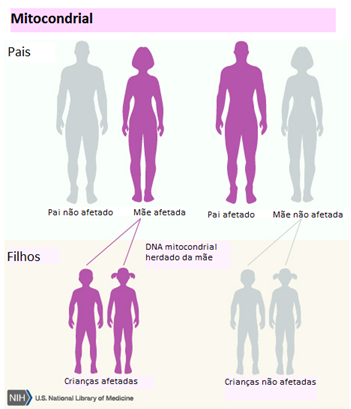
Fonte: U.S. National Library of Medicine16 editado por Carolina Angélico
Figura 5 - Herança Recessiva Ligada ao Cromossomo X
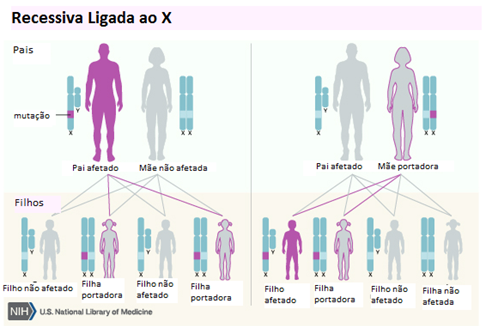
Fonte: U.S. National Library of Medicine17 editado por Carolina Angélico
Para entender as possíveis alterações mitocondriais, é necessário discutir um pouco mais sobre as estruturas e funções desta organela. A respiração aeróbica celular, feita na mitocôndria, pode ser dividida em três partes principais: glicólise, ciclo de Krebs (ou ciclo do ácido cítrico) e cadeia respiratória (ou fosforilação oxidativa). A fosforilação acontece na membrana interna da mitocôndria e conta com a atuação de 5 complexos multiproteicos, numerados de I à V, e com a coenzima Q (CoQ10) e o citocromo c (Cyt c) que são transportadores de elétrons. O piruvato, advindo da quebra da glicose, é metabolizado por uma enzima com a finalidade de gerar doadores de elétrons que atuarão no ciclo de Krebs. Os complexos de I a IV fazem parte da cadeia respiratória e são responsáveis por direcionar o fluxo de elétrons resultantes do ciclo citado anteriormente. A transferência de elétrons gera energia que é usada na fosforilação oxidativa para bombear H+, através dos complexos, para o espaço intermembranoso, criando um grande gradiente de concentração desses prótons que será usado pela ATP sintase (ATPase), no complexo V, para a produção de ATP. Quaisquer alterações na enzima que metaboliza o piruvato, nos 5 complexos, na coenzima Q e no citocromo c podem causar essa patologia10 (Figura 6 - Cadeia de Transporte de Elétrons).Dessa forma, mesmo que a mutação esteja no DNA nuclear, o produto (proteínas) desse gene será utilizado para o funcionamento da mitocôndria, e se o gene estiver mutado, consequentemente, seu produto genético também estará, alterando as funções mitocondriais.
Figura 6 - Cadeia de Transporte de Elétrons
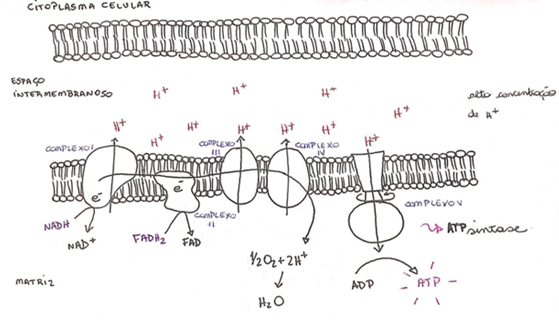
Fonte: Elaborada pela autora.
Alterações no complexo I, também chamado de NADH, são umas das principais bases bioquímicas dessa patologia. Podem incluir, por exemplo, deficiências no NADH, alterando o processo de transporte de elétrons. Pelo menos 25 genes envolvidos na formação do complexo I, encontrados em DNA nuclear ou mitocondrial, foram associados à síndrome de Leigh. Os genes alterados podem ser, por exemplo: NDUFS4, NDUFV1, NDUFS110.
O rompimento do complexo IV, também chamado de citocromo c oxidase ou COX, é outra causa comum da síndrome de Leigh, cujas alterações estão relacionadas a cerca de 15% dos casos da patologia. Um dos genes mais frequentemente mutados na síndrome de Leigh é o SURF1. Esse gene, encontrado no DNA nuclear, fornece instruções para a produção de uma proteína que ajuda a montar o complexo IV11.
A mutação mais comum do DNA mitocondrial na síndrome de Leigh afeta o gene MT-ATP6, que fornece instruções para a produção de um pedaço do complexo V, também conhecido como complexo proteico da ATP sintase. A mutação mais ocorrente nele é a transversão 8993T>G2.
Ou seja, como dito anteriormente, são muitas as mutações já encontradas que podem causar a Síndrome de Leigh (Tabela 1).
Tabela 1: principais genes mutados associados a síndrome e o local onde são encontrados

Fonte: Elaborada pela autora.
Como as mitocôndrias são herdadas?
Na fecundação, o zigoto formado pela junção do ovócito e espermatozoide, idealmente, herda as mitocôndrias de sua mãe. Se a mãe possuir mutações em seu DNA mitocondrial, seus filhos, independente do sexo biológico, também apresentarão essas alterações. É importante ressaltar, portanto, que, apesar de ambos os sexos possuírem a mutação, normalmente a mulher que repassará essa alteração para as gerações futuras. Entretanto, há a possibilidade de acontecer o chamado vazamento de mitocôndrias paternas, de tal forma que os filhos passarão a herdar essas organelas não mais só de sua mãe, mas também de seu pai12.
Outros aspectos importantes na herança da síndrome:
A síndrome pode ser expressa por heteroplasmia (Quadro 1), isto é, quando algumas células que contém moléculas de DNA mitocondrial possuem a mutação, que serão repassadas através da divisão celular, e outras não (Figura 7)9.
Figura 7- Células sofrendo divisão e replicação contendo mitocôndrias mutadas e não mutadas
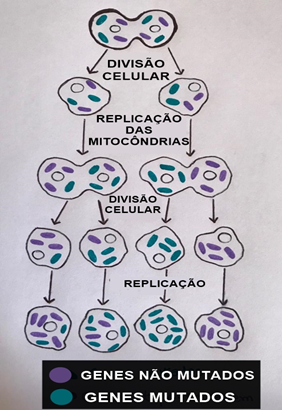
Fonte: elaborada pela autora.
Assim, a proporção de alterações no DNA mitocondrial vai se alterando entre as células mãe e filha. Em certo ponto, quando essa diferença de proporção for significativa, pode acontecer o chamado efeito limiar (Quadro1), ocasionando mudanças fenotípicas (Figura 8). Os sintomas geralmente aparecem quando há grande quantidade de DNA mutado, normalmente quando o nível é superior a 90%. Dessa forma, é comum que algumas pessoas demorem um pouco mais para manifestar essa patologia9.
Figura 8- Efeito de limiar/Threshold
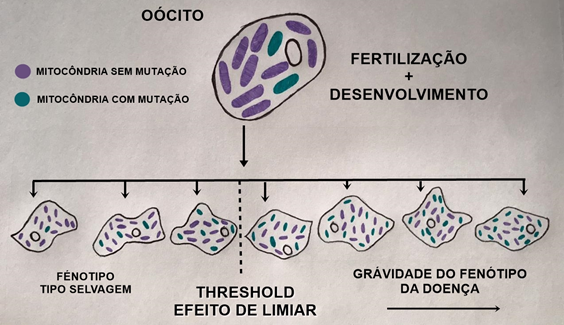
Fonte: elaborada pela autora.
Formas de diagnóstico4 :
- Histórico médico: se há consanguinidade, casos similares na família, aborto recente; se há regressão psicomotora ou perda de habilidades adquiridas; exclusão da possibilidade de diagnóstico de outras doenças como asfixia perinatal, intoxicação por monóxido de carbono, doença de Wilson, entre outros;
- Exame físico: procurando por sintomas sugestivos como os citados anteriormente;
- Exames laboratoriais: nível de ácido lático procurando por uma possível acidose; painel laboratorial geral com parâmetros hepáticos, renais, nível de amônia, entre outros;
- Ressonância magnética: por meio de RM, as anormalidades consistem em lesões focais bilaterais dos gânglios basais e/ou tronco cerebral;
- Tomografia computadorizada (TC): evidência imagens hipodensas nos núcleos da base. Geralmente, as alterações possíveis de serem vistas em exames computadorizados, se localiza nos núcleos da base, tálamo, tronco cerebral e medula espinhal 1(Figura 9).
Figura 9 – Regiões do cérebro com possível alteração no portador da síndrome.
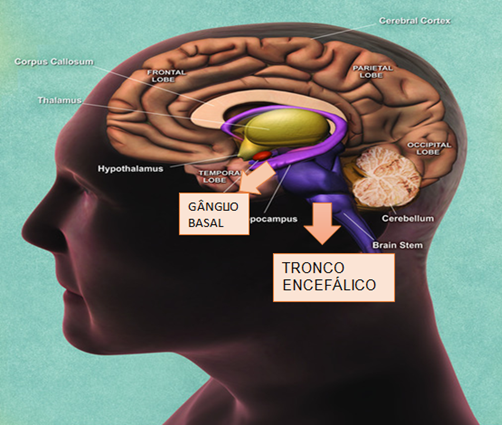
Fonte: National Institute on Aging / National Institutes of Health19. Editado por Livea Silva.
4. Fisioterapia:
A Fisioterapia, junto a outros tratamentos, busca melhorar a qualidade de vida dos pacientes com a síndrome, manter a funcionalidade restante e aumentar a expectativa de vida que é, geralmente, muito baixa5.
Programas de Fisioterapia com intervenção precoce também são efetivos para ajudar no desenvolvimento neurológico de pacientes com a síndrome4.
O estudo de Oommen et al. (2019) mostrou que um programa de Fisioterapia voltado para a reabilitação de uma criança de 7 anos teve bons resultados, com melhorias em ações como sentar, ficar em pé e andar.
Tendo em vista que os sistemas mais afetados são o muscular, o nervoso e o respiratório, o fisioterapeuta é capacitado para atuar nesses aspectos, visando dar uma melhor qualidade de vida e alta chance de melhora funcional para esses pacientes6. Um exemplo dessa atuação é o uso de exercitadores respiratórios - aparelhos destinados ao treino da respiração do paciente que auxiliam o desempenho muscular do pulmão e sua capacidade respiratória, aumentando a oxigenação7.
Na síndrome de Leigh, os objetivos fisioterapêuticos têm como finalidade a diminuição da espasticidade (hipertonia e hiperreflexia) em MMSS (membros superiores) e MMII(membros inferiores), o ganho de amplitude de movimento, o ganho de controle de tronco e cervical, a melhora dos movimentos de flexão e extensão de MMII e MMSS e a melhora da função respiratória 6. O estudo de Gonzáles et al. (2002) mostrou que as metas de um programa de reabilitação são reduzir a incapacidade e aperfeiçoar a função. Os alongamentos dos músculo tendinosos devem ser lentos e realizados diariamente para manter a amplitude de movimento e reduzir o tônus muscular.
Quadro 1 . GLOSSÁRIO
|
Encefalopatia |
Doença ou mal funcionamento do cérebro.
|
|
Efeito de limiar |
É quando atinge uma proporção significativa de DNA mutado, e o indivíduo começa a ter manifestações fenotípicas.
|
|
Gene |
É uma unidade básica de herança, que traz informações de uma geração para outra.
|
|
Heterogeneidade |
Diferentes tipos de mutações no mesmo lócus da doença.
|
|
Heteroplasmia
|
É uma condição na qual há presença de DNA mitocondrial mutante e o selvagem(normal), dentro das mitocôndrias, ocorrido em uma situação aleatória.
|
|
Hipertonia muscular |
Tensão excessiva no músculo.
|
|
Hiporreflexia |
Diminuição do reflexo no corpo. |
5. Produto produzido sobre Síndrome de Leigh
Link para o blog sobre Síndrome de Leigh
6. Equipe:





Lorenna J. Gatto Lívea C. da Silva Carolina Angelico Isabela Assunção Eduarda Senni
Bragança da Silva
7. Bibliografia
- ROMA, A. C. et al. Síndrome de Leigh: relato de caso. Arquivos brasileiros de oftalmologia, vol. 71, p. 118-121, 2008.
- LOPES, T. et al. Síndrome de Leigh: a propósito de um caso clínico com mutação no DNA mitocondrial. Revista paulista de pediatria : órgão oficial da Sociedade de Pediatria de São Paulo, vol. 36, p. 519-523, 2018.
- SOFOU, K. et al. A multicenter study on Leigh syndrome: disease course and predictors of survival. Orphanet journal of rare diseases, vol. 9, nº artigo 52, 16 páginas, 2014.
- BAERTLING, F. et al. A guide to diagnosis and treatment of Leigh syndrome. Journal of neurology, neurosurgery, and psychiatry,vol. 85, p. 257-265, 2014.
- OOMMEN, F. S. et al. Physiotherapy and Its Implications on Functional Disability in a Child with Leigh’s Syndrome: An Interesting Case Report. Indian Journal of Physiotherapy and Occupational Therapy, vol. 13, p. 38-40, 2019.
- NASCIMENTO, C. E. et al. Tratamento fisioterápico na síndrome de Leigh: estudo de caso. Journal of the Health Sciences Institute, vol. 31, p. 330-334, 2013.
- PRESTO, B.; DAMÁSIO, L. Fisioterapia respiratória. 4ª ed. Elsevier Brasil, 2009.
- CALDERÓN-GONZÁLEZ, R. et al. Tratamiento de la espasticidad en parálisis cerebral con toxina botulínica. Revista de neurología (Ed. impressa), vol. 34, p. 52-59, 2002.
- RIBEIRO, B. S. Caracterização clínica, neurorradiológica e genética de pacientes com síndrome de Leigh. Dissertação (Mestrado em Medicina) - Faculdade de Medicina, Universidade Federal de Minas Gerais. Belo Horizonte, p. 108. 2015.
- 1 LAKE, N.J.; COMPTON, A.G.; RAHMAN, S.; THORBURN, D. R. Leigh syndrome: One disorder, more than 75 monogenic causes. Annals of neurology, vol. 79, p. 190-203, 2016.
- LEIGH Syndrome. MedlinePlus, 2016. Disponível em: <https://medlineplus.gov/genetics/condition/leigh-syndrome/#references>. Acesso em 2 dez. 2020.
- LADOUKAKIS, E. D.; EYRE-WALKER, A. Evolutionary genetics: direct evidence of recombination in human mitochondrial DNA. Heredity, vol. 93, p. 321, 2004.
- OSELLAME, L. D.; BLACKER, T. S.; DUCHEN M. R. Cellular and molecular mechanisms of mitochondrial function. Best practice & research. Clinical endocrinology & metabolism, vol. 26, p. 711-723, 2012.
- MEDLINEPLUS Genetics. Disponível em: <https://medlineplus.gov/images/PX00004O_PRESENTATION.jpeg;. Acesso em 2 dez. 2020.
- MEDLINEPLUS Genetics. Disponível em: <https://medlineplus.gov/images/PX0000A4_PRESENTATION.jpeg;. Acesso em 2 dez. 2020.
- MEDLINEPLUS Genetics. Disponível em: <https://medlineplus.gov/images/PX00005K_PRESENTATION.jpeg;. Acesso em 2 dez. 2020.
- 17. MEDLINEPLUS Genetics. Disponível em: <https://medlineplus.gov/images/PX000068_PRESENTATION.jpeg;. Acesso em 2 dez. 2020.
- MITOCHONDRIAL Disease Symptons. Disponível em: <https://www.mitoaction.org/symptoms/>. Acesso em 4 jan. 2021.
- NATIONAL INSTITUTE ON AGING / NATIONAL INSTITUTES OF HEALTH. Brain side view. Disponível em: https://www.flickr.com/photos/nihgov/24414866102/in/album-72157663368688842/. Acesso em 08 jan. 2021.
