Distrofia Muscular de Duchenne
- Descrição da patologia
As distrofias musculares são um grupo de doenças hereditárias caracterizadas por fraqueza muscular ligadas ao gene DMD (dystrophin) e que avançam progressivamente. Os mais conhecidos são a istrofia Muscular de Duchenne (DMD) e a Distrofia Muscular de Becker (DMB), as quais são o foco deste trabalho. São condições genéticas, ligadas ao cromossomo X, geralmente herdado da mãe que é a portadora. O sistema músculo esquelético é afetado, levando a fraqueza muscular progressiva. Duchenne é a doença muscular mais comum em crianças, com uma incidência de cerca de 1 em 3.500 a 5.000 nascidos vivos do sexo masculino. O diagnóstico é dado ainda nos primeiros anos de vida, e seus principais sintomas são: distúrbio da marcha, hipertrofia das panturrilhas, andar nas pontas dos pés, dificuldade para se levantar, pular, correr entre outras. Com o passar dos anos a degeneração dos músculos aumenta acarretando problemas respiratórios e possibilitando o indivíduo ao uso da cadeira de rodas ¹.
Já a distrofia de Becker é uma forma mais branda da doença, porém com os mesmos sintomas e dificuldades, a diferença entre elas é o início tardio e progressão clínica mais lenta, encontrada em Becker. A diferença entre Duchenne e Becker geneticamente, é explicada pela hipótese do quadro de leitura, mutações que interrompem o quadro de leitura genético, causando uma interrupção prematura. As mutações que retêm o quadro de leitura geram uma proteína encurtada. Dessa forma, ambas DMD e DMB estão ligadas à proteína distrofina. Na síndrome de Duchenne ocorre a ausência dessa proteína, já na síndrome de Becker ocorre uma mutação no gene dessa proteína tornando-a defeituosa. Sendo assim, a DMD é mais agressiva pela ausência dessa proteína ¹.
- Parte biológica
A distrofina é uma proteína citoesquelética, de 427 KDa, expressa a partir do gene DMD, que está relacionado com as doenças de Duchenne e Becker. Juntamente ao seu complexo fortemente associado, a distrofina (Figura 1) está localizada dentro dos costâmeros, que é uma rede citoesquelética que fisicamente acopla o sarcolema e os sarcômeros por meio de extensas redes de interação ². Normalmente, sua função é de atuar como um amortecedor durante a contração das fibras musculares, ligando a actina do aparelho contrátil à camada de tecido conjuntivo que envolve cada fibra muscular ³.
Figura 1- Distrofina desempenhando sua função de ligação entre o citoesqueleto e a lâmina basal (tecido conjuntivo)
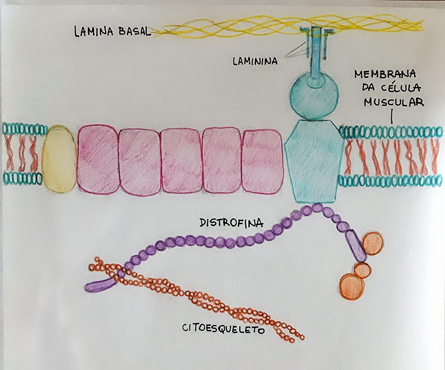
Fonte: acervo do autor, 2020.
A proteína distrofina consiste em 4 domínios funcionais principais. O primeiro domínio, N-terminal, é codificado pelos éxons 1 a 8 e possui função principal de se ligar à actina. Já a parte central da distrofina, codificada pelos éxons 8 a 61, é composta por 24 repetições semelhantes à espectrina, intercaladas por 4 dobradiças H1 a H4. Este longo domínio interage com um grande número de proteínas, entre as quais podemos citar a actina filamentosa, filamentos intermediários, microtúbulos e a isoforma muscular de óxido nítrico sintase (nNOS) e PAR1-b. Além disso, esse domínio interage com os fosfolipídios da membrana. Já o terceiro domínio, por sua vez, é rico em cisteína e é codificado pelos éxons 62 a 69. Este, se liga à β-distroglicana, o parceiro mais importante da distrofina, e a várias outras proteínas, como plectina, anquirina e sinemina. Por fim, o domínio C-terminal, codificado pelos éxons 69 a 79, liga-se às duas proteínas citoplasmáticas sintrofina e distrobrevina 4 5.
A função essencial da distrofina no músculo é estabilizar as fibras durante as contrações, ligando à F-actina com domínio N-terminal e β-distroglicana com domínio C-terminal, agindo como encurtador e proteína de ancoragem. Assim, esta se apresenta como a principal proteína de suporte do músculo normal que liga a actina do citoesqueleto, microtúbulos e filamentos intermediários à matriz extracelular 4.
Quando mutações ocorrem, a falta de distrofina ou a alteração em sua estrutura impedem sua função de manutenção da membrana celular, levando a frequentes rupturas desta durante as contrações. A ruptura permite com que mais cálcio do meio extracelular entre na célula, ativando um número elevado de proteases, que, por sua vez, quebram proteínas funcionais, causando a morte celular. Além disso, a abertura da membrana libera uma grande quantidade de creatina quinase, responsável pela reserva energética para ativação muscular. Essa ausência de creatina quinase na célula enfraquece os músculos e explica os altos níveis de creatina quinase da membrana plasmática no sangue de crianças que sofrem com a Distrofia muscular de Duchenne e Becker 4.
Com a perda de conexão entre o citoesqueleto de actina e o tecido conjuntivo, as fibras musculares são facilmente danificadas durante a contração, levando a danos musculares crônicos, inflamação e, eventualmente, substituição das fibras musculares por tecido adiposo e fibrótico e, portanto, perda da função muscular ³. O déficit ou mutação da distrofina induz um comprometimento muscular progressivo, ou seja, o músculo é capaz de funcionar sem a distrofina, porém, não é capaz de resistir às forças por um longo tempo 4.
Os primeiros sinais clínicos de DMD se apresentam na infância, em geral nos 3 primeiros anos de vida, em que os meninos apresentam dificuldades para andarem e subirem escadas. No estágio inicial da doença é possível notar um aumento da musculatura da panturrilha, causado pela proliferação anormal do tecido intersticial em fibras do músculo gastrocnêmio. Essa proliferação, por sua vez, resulta numa firmeza e resistência do músculo, denominada pseudo-hipertrofia muscular, que pode vir a envolver outros grupos musculares. Assim, inicialmente, há um comprometimento simétrico da musculatura, acompanhado de déficit motor da cintura pélvica e, posteriormente, outros músculos, como o da cintura escapular, são afetados de maneira progressiva 6.
Em torno dos 5 anos de idade, a fraqueza muscular torna-se evidente, e as crianças passam a apresentar dificuldades para saltar, pular e correr. A fraqueza dos músculos glúteo médio e glúteo mínimo resultam na inclinação da pelve quando o indivíduo se mantém em bipedestação e, para suportar essa inclinação, este realiza uma compensação alargando sua base de sustentação, o que induz uma marcha do tipo anserino. Já a fraqueza do glúteo máximo, principal músculo extensor do quadril, também induz a inclinação anterior da pelve, que é compensada com o aumento da lordose lombar. Com a progressão da doença, ocorre um aumento da lordose lombar com exagero da marcha anserina 6.
Na Figura 2, a seguir, é retratado um menino de 7 anos com distrofia muscular de Duchenne. É possível perceber uma pseudo-hipertrofia dos membros inferiores e, na figura à direita, a hiperlordose lombar.
Figura 2- Desenho de menino com distrofia muscular de Duchenne.
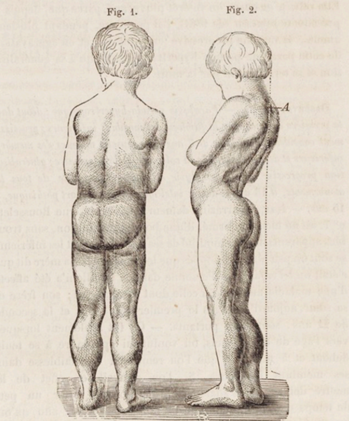
Fonte: DUCHENNE, 1868 - CC BY-SA 3.0 - disponível no repositório digital Wikimedia Commons
A maneira como crianças que possuem DMD se levantam do chão também é característica. Como a força da musculatura extensora do joelho e do quadril não são suficientes para permitir a extensão voluntária do tronco, eles realizam uma compensação utilizando suas mãos apoiadas nos joelhos. Dessa forma, utilizam os membros inferiores como alavancas e gradualmente estendem o tronco, dando a impressão de uma escalada ao longo dos membros inferiores (Figura 3). Essa manobra compensatória é denominada manobra de Gowers 6.
Figura 3- Manobra de Gowers
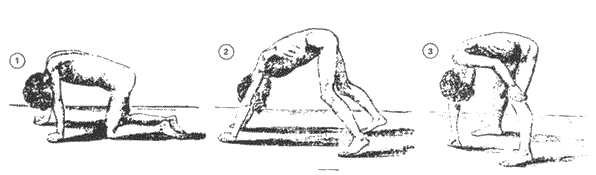
Fonte: GOWERS, 1879 - CC BY-SA 3.0 - disponível no repositório digital Wikimedia Commons
Deformações ortopédicas tendem a surgir devido a posições viciosas em níveis de várias articulações. Alterações ósseas também não são decorrentes de falhas genéticas, mas decorrentes exclusivamente do desuso, incluindo rarefação encontrada nas extremidades dos ossos longos e formação de ossos chatos. Em estágios tardios, ocorre a descalcificação e distorções grosseiras com desorganização do sistema musculoesquelético, o que faz com que os ossos desses pacientes sejam susceptíveis a fraturas por pequenos traumas 6.
Embora existam variações nas evoluções dos quadros clínicos, normalmente, os pacientes afetados por DMD não são capazes de andar após os 16 anos de idade. Assim, após a restrição no leito, apresentam uma progressão rápida da perda de força devido à imobilidade, o que acarreta em complicações respiratórias, as quais se mostram como a principal causa de morte entre os indivíduos com DMD. A musculatura cardíaca também é afetada, sendo que os achados patológicos em músculo cardíaco de DMD apresentam fibrose de características únicas, com boa diferenciação histológica da fibrose difusa que ocorre em doença isquêmica do coração. Na maioria dos casos, os pacientes não sobrevivem após seus 30 anos 6.
Já a distrofia muscular do tipo Becker (BMD) apresenta sinais e sintomas semelhantes aos da distrofia de Duchenne, porém, com início da manifestação mais tardia e a evolução clínica da doença, mais lenta. Além disso, em relação à DMD, a BMD é uma doença muito mais heterogênea clinicamente, ou seja, o quadro clínico deste tipo de distrofia apresenta uma variabilidade muito grande, podendo haver, em uma mesma família, indivíduos com diferentes graus de comprometimento muscular 7.
- Parte Genética
Cromossomos são as formas compactadas do DNA. Nós, humanos, possuímos 46 cromossomos em cada célula em condições normais, sendo 23 pares provenientes da mãe e 23 do pai; desses 23 pares, 22 são autossômicos e 1 par de cromossomos sexuais. Cromossomos autossômicos não têm influência no sexo biológico do indivíduo e são numerados de 1 a 22. Cromossomos sexuais são divididos em X e Y em humanos; a presença da combinação XX indica a formação de um indivíduo do sexo biológico feminino, enquanto a combinação XY indica a formação de um indivíduo do sexo biológico masculino.
Genes, por sua vez, são regiões fixas do cromossomo que possuem informação para a produção de um produto funcional. Eles podem ser responsáveis por expressar determinadas características nos indivíduos, e alterações nos genes podem gerar doenças e síndromes, como é o caso de Duchenne e Becker. Os cromossomos de um mesmo par possuem os mesmos genes, mas podendo ter alelos diferentes, que são formas distintas do gene, determinando características variadas de acordo com a combinação dos alelos e seu tipo de interação. A combinação dos genes de uma pessoa é chamada de genótipo, e a expressão das características e doenças dessa pessoa é chamada de fenótipo.
O gene DMD (dystrophin) é o gene humano mais longo e está localizado no braço curto do cromossomo X (locus Xp21.2-p21.1)(Figura 4). Esse gene possui um grande número de mutações associadas ao seu déficit no organismo, sendo 65% de deleções de um ou mais exons, 6-10% de duplicação de éxons e cerca de 25% de mutações menores 8. A ocorrência de mutações no gene pode afetar a síntese de distrofina. Em caso de mutações que não alteram o quadro de leitura, a distrofina produzida é parcialmente funcional, sendo, na maioria das vezes, causa de BMD, mas podendo causar DMD. Já quando a mutação resulta em uma alteração no quadro de leitura aberto, o término prematuro resulta em uma proteína truncada (ou nenhuma proteína), que é frequentemente associada ao fenótipo DMD 9 .
Figura 4: localização do gene DMD no cromossomo X
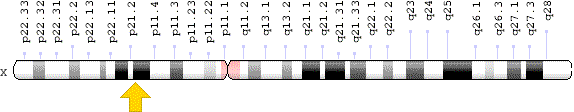
Fonte: Genome Decoration Page/NCBI, 2017 - CC BY-SA 3.0 - disponível no repositório digital Wikimedia Commons
As síndromes de Duchenne e Becker possuem herança recessiva ligada ao cromossomo X (Figura 5). Isso significa que o gene em cuja mutação gera as síndromes está localizado no cromossomo sexual X e é necessário que todos os alelos desse gene possuam a mutação para haver a manifestação da condição (recessividade). Isso explica a maior incidência em homens: mulheres possuem dois cromossomos X, portanto, com a mutação no gene DMD de apenas um dos cromossomos X, ela é portadora da mutação, mas só manifesta a doença em caso de ter a mutação no gene de ambos os cromossomos X; os homens possuem apenas um cromossomo X, então, com a mutação no gene DMD desse único cromossomo ele já manifestará a síndrome.
Figura 5: Padrão de herança recessiva ligada ao cromossomo sexual X
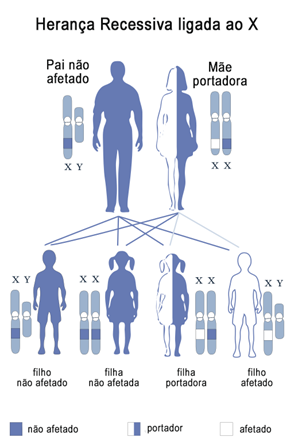
Fonte: National Institutes of Health, 2010 - Editado por Henrique Jábali - CC BY-SA 3.0 - disponível no repositório digital Wikimedia Commons
Em cerca de ⅔ dos casos de DMD, a mutação no gene é herdada da mãe portadora. Mulheres nessa condição possuem 50% de transmitir o gene a seus descendentes diretos 10. O pai do homem com DMD foi responsável por passá-lo o cromossomo Y, por isso não tem influência na condição do filho. Em casos de mulheres com DMD, há contribuição do pai com um dos cromossomos X, tendo assim influência na doença da filha. É importante ressaltar a possibilidade de mutação no gene após a fecundação, de forma que nenhum dos parentais do indivíduo acometido possua a mutação no gene.
Outra questão genética que permeia as síndromes de Duchenne e Becker é a heterogeneidade genética. A heterogeneidade genética indica a distinção de genótipos para características ou doenças com fenótipos muito similares, que podem parecer a mesma condição 11. Apesar do fenótipo parecido entre as distrofias, elas possuem genótipo distinto com base em diferentes mutações do gene DMD. Ambas são distrofias musculares e apresentam limitação de movimento dos indivíduos afetados, apresentando dificuldade de marcha e podendo afetar o pulmão e o coração, porém, a DMD é mais severa, com sintomas mais graves e que, na maioria dos casos, aparecem mais cedo que nos pacientes com BMD. Nas mulheres, enquanto a BMD afeta de forma mais branda, a DMD pode se manifestar de forma leve em casos de mulheres portadoras 12 13. Há diferenças consideráveis quanto à incidência e idade de diagnósticos entre as síndromes (Tabela 1).
Tabela 1 - comparação entre a incidência em meninos nascidos vivos, idade do início dos sintomas e idade de diagnósticos das distrofias musculares de Duchenne e Becker
|
|
Duchenne |
Becker |
|
Incidência em meninos nascidos vivos |
1/3500 - 1/5000 13 |
1/18000 - 1/31000 12 |
|
Idade do início dos sintomas |
Cerca de 1 ano e 6 meses 13 |
Cerca de 11 anos 12 |
|
Idade de diagnóstico |
De 3 a 5 anos 13 |
Cerca de 11 anos 12 |
Fonte: acervo do autor, 2020.
- Diagnóstico
- Análise dos químicos presentes no sangue
O nível sérico de Creatina Quinase (CK) é quase sempre o primeiro teste de diagnóstico realizado uma vez suspeitado o diagnóstico de DMD ou BMD. É sempre elevado, frequentemente 50 a 100 vezes normal em DMD, e inferior em BMD, onde atinge um pico de cerca de 10 a 15 anos de idade 7. Também é elevado ao nascimento, o que leva à sua utilização como instrumento de rastreio de recém-nascidos 7.
É importante ressaltar que a Creatina Quinase não é a única enzima elevada no soro de pacientes com DMD e BMD. As transaminases aspartato aminotransferase e alanina-aminotransferase também são elevadas e correlacionadas com a CK sérica.7
- Análise de mutação
A análise da mutação do gene DMD substituiu em grande parte a biópsia muscular como o primeiro teste diagnóstico realizado após o teste Creatina Quinase do soro. Representa agora o padrão de cuidados, não só porque pode fornecer informações prognósticas, mas também porque facilita o aconselhamento genético e pode determinar a aptidão para terapias inovadoras específicas. A análise mutacional do DNA genômico pode detectar até cerca de 95% das mutações. 7
- Biópsia muscular
O papel da biópsia muscular no diagnóstico de DMD e BMD tornou-se menos importante à medida que a análise da mutação molecular tem melhorado. No entanto, a biópsia muscular é ainda necessária para estabelecer o mecanismo mutacional em alguns pacientes. Além disso, a ausência ou alteração da expressão da distrofina continua a ser o padrão de ouro de diagnóstico de uma distrofinopatia.7
A expressão da proteína distrofina pode ser avaliada por coloração imunofluorescente (IF) ou imunohistoquímica (IHC) de seções musculares, ou por análise de imunotransferência (Western blot) de tecido homogeneizado. Na prática clínica, a coloração IF ou IHC demonstra a localização da distrofina e permite descritores semiquantitativos de quantidade (ou seja, “ausente”, “reduzido”, “traços”). No músculo normal, a distrofina decora a membrana sarcolemal uniformemente, já no músculo com BMD, a coloração é reduzida e frequentemente irregular, e na DMD, está ausente. A análise de imunotransferência, por sua vez, fornece informações sobre o tamanho da proteína e permite uma avaliação mais quantitativa.7
- Tratamento
Apesar da DMD estar relacionada principalmente à distúrbios musculoesqueléticos, esse não é o único sistema afetado pela doença. Além do cérebro, o sistema respiratório e cardíaco, por exemplo, também são diretamente afetados pela ausência ou deficiência da distrofina. Por essa razão, o paciente com DMD geralmente necessita de um tratamento multidisciplinar, que envolve especialistas em diversas áreas diferentes, como fisioterapeuta, terapeuta ocupacional, cardiologista, nutricionista, entre outros.7
Quando nos referimos à medicamentos, até então, apenas os corticosteróides prednisona e deflazacort demonstraram afetar o curso clínico da DMD, sendo considerado um tratamento padrão. Apesar dos mecanismos por trás do efeito desse tratamento ainda serem desconhecidos, estudos clínicos demonstraram que a administração de 0,75 mg por quilograma de prednisona, por dia, resultou em melhora da força muscular em 6 meses.7
Para o tratamento da cardiomiopatia, consequência muito comum da DMD, utiliza-se da redução da pós-carga, usando inibidores da enzima conversora de angiotensina ou bloqueadores do receptor de angiotensina. Já em relação à insuficiência pulmonar, o uso rotineiro de dispositivos insuflador /exsuflador mecânico (CoughAssist) diminui a morbidade pulmonar e deve ser considerado. Além disso, polissonogramas anuais após a perda da deambulação são indicados e a ventilação noturna pode melhorar a qualidade de vida.7
A escoliose também é muito comum entre os indivíduos com DMD, afetando 77% desses. Ela pode ser retardada ou minimizada pelo uso de esteróides, porém, também é necessário um acompanhamento ortopédico, que deve realizar radiografias anuais com o intuito de avaliar a progressão da condição.7
Por fim, o uso de talas também é muito recomendado como possível tratamento. Ao utilizar talas noturnas regularmente, pode ocorrer uma diminuição da contratura muscular, uma vez que essa proporciona um alongamento contínuo do músculo por um longo período de tempo.7
- Tratamento fisioterapêutico para Duchenne e Becker
O tratamento fisioterapêutico para as Síndromes de Duchenne e Becker segue uma linha semelhante, visto que ambas são doenças neuromusculares, genéticas, degenerativas e incuráveis, que se manifestam logo na primeira infância ou pouco mais tardiamente, como é o caso de Becker. Essas distrofias afetam a parte motora da criança, acometendo a capacidade de interação entre a via neuronal e o sistema musculoesquelético, propiciando assim, fraqueza dos membros superiores, inferiores, cinturas escapular e pélvica, além do controle da musculatura cervical e do tronco 14.
O papel do fisioterapeuta é retardar a evolução clínica das doenças e manter ou melhorar a qualidade de vida do paciente acometido – de acordo com a faixa etária e a progressão das síndromes. Diante deste cenário, o profissional precisa ficar atento, principalmente, às questões secundárias que levam ao agravamento de ambos os quadros, o que culmina em doenças do sistema cardiorrespiratório – devido ao enfraquecimento muscular. Visto que o paciente é um ser biopsicossocial, é de suma importância mantê-lo motivado para as sessões fisioterapêuticas 14.
Na consulta com o fisioterapeuta é realizada, primeiramente, uma sessão para a anamnese – que consiste em avaliar o paciente com relação às informações sobre o quadro apresentado. Nesta anamnese são analisados: histórico da moléstia atual e pregressa, aferições de peso, altura, grau de força muscular, grau de escoliose, testes envolvendo estesiometria, avaliação de perda de massa muscular, atrofias, capacidade cognitiva – neuro funcional – grau de progresso da doença já instalada (também de acordo com laudo médico) e demais testes que implicam saber quem é aquele paciente que chegou até o serviço fisioterapêutico e como é possível ajudá-lo mediante às suas particularidades dentro do contexto das distrofias em questão. Além disso, é importante colher o histórico familiar, visto que são doenças de cunho genético 15.
Após realizada uma boa anamnese, é de suma importância estudar para aquele paciente qual a melhor maneira de propor exercícios que o ajudem a retardar a progressão de sua doença e conferir-lhe certa qualidade de vida. Geralmente, os pacientes com as Síndromes de Duchenne e Becker realizam exercícios em solo e aquáticos, envolvendo alongamento dos diversos grupos musculares superiores, inferiores, de cinturas pélvica, escapular e de tronco; exercícios de mobilidade, que consistem em melhorar a capacidade musculoesquelética e respiratória deste paciente (podem ser feitos em solo, tablado ou piscina); exercícios de fortalecimento muscular – que serão embasados no grau de perda muscular já apresentado pelo paciente; exercícios de marcha em barras paralelas; exercícios que envolvem a cognição e, também, exercícios que apliquem uma dupla tarefa, ou seja: enquanto o paciente realiza um exercício de fortalecimento muscular, concomitantemente, ele associa outra atividade de cunho cognitivo 14.
Como este paciente tem uma doença que leva progressivamente ao enfraquecimento do sistema musculoesquelético, é necessário trabalhar os grupamentos musculares que auxiliam a manter uma boa dinâmica cardiorrespiratória, para que os pulmões mantenham a elasticidade necessária ao ciclo de inspiração e expiração, concomitante ao funcionamento da bomba cardíaca. São trabalhados os grupamentos musculares laterais ao tronco e também os anteroposteriores. Para contemplar essa necessidade, os exercícios de treino respiratório são muito importantes e auxiliam no fortalecimento da musculatura da caixa torácica 15.
Exercícios de transferência de peso – seja do próprio corpo do paciente ou com auxílio de faixas elásticas, halteres ou bola, são muito importantes pois trabalham, tanto a questão de propriocepção do paciente, quanto a capacidade de mudança de decúbito nas atividades cotidianas. Ademais, auxiliam a manter o equilíbrio – evitando quedas da própria altura, e permitem ao paciente manter-se mais funcional – dependendo do grau de acometimento já instalado 14.
Em suma, a atuação do fisioterapeuta com um paciente portador das Síndromes de Duchenne e Becker não tem um prazo estabelecido para começo e fim da terapia, visto que, o mais evidente, de acordo com a literatura é manter o tratamento ao longo da vida deste paciente. Os objetivos são retardar o processo de acometimento das doenças já instaladas e tornar o paciente mais funcional dentro de seu próprio limite, além de evitar problemas cardiorrespiratórios, gastrointestinais – ligados ao peristaltismo e, também, neuro funcionais – relacionados à cognição.
- Produto produzido sobre a Síndrome de Duchenne
Link para o podcast sobre Síndrome de Duchenne.
- Equipe:



Lívia B. Nardini Henrique Granado Jabali Jéssica A. C. Scotti Ferreira Natália F. Bittercourt
- Referências Bibliográficas
¹ BELLAYOU, H. et al. Duchenne and Becker muscular dystrophy: contribution of a molecular and immunohistochemical analysis in diagnosis in Morocco. Journal of biomedicine & biotechnology, v. 2009, p. 325210, 19 maio 2009.
² LE, S. et al. Dystrophin As a Molecular Shock Absorber. ACS Nano, 2018. Disponível em: <http://dx.doi.org/10.1021/acsnano.8b05721>
³ AARTSMA-RUS, A.; GINJAAR, I. B.; BUSHBY, K. The importance of genetic diagnosis for Duchenne muscular dystrophy. Journal of Medical Genetics, 2016. Disponível em: <http://dx.doi.org/10.1136/jmedgenet-2015-103387>
4 RUMEUR, E. L.; LE RUMEUR, E. Dystrophin and the two related genetic diseases, Duchenne and Becker muscular dystrophies. Bosnian Journal of Basic Medical Sciences, 2015. Disponível em: <http://dx.doi.org/10.17305/bjbms.2015.636>
5 GAO, Q. Q.; MCNALLY, E. M. The Dystrophin Complex: Structure, Function, and Implications for Therapy. Comprehensive Physiology, 2015. Disponível em: <http://dx.doi.org/10.1002/cphy.c140048>
6 CAROMANO, F. A. Características do portador de distrofia muscular de Duchenne (DMD) - Revisão. Arq. Ciênc. Saúde Unipar, 3(3): 211-218, 1999. (6)
7 WEIN, N.; ALFANO, L.; FLANIGAN, K. M. Genetics and emerging treatments for Duchenne and Becker muscular dystrophy. Pediatric clinics of North America, v. 62, n. 3, p. 723–742, 2015. (7)
8 FALZARANO, M. et al. Duchenne Muscular Dystrophy: From Diagnosis to Therapy, 2015. Disponível em: <http://dx.doi.org/10.3390/molecules201018168>
9 WILSON, K. et al. Duchenne and Becker Muscular Dystrophies: A Review of Animal Models, Clinical End Points, and Biomarker QuantificationToxicologic Pathology, 2017. Disponível em: <http://dx.doi.org/10.1177/0192623317734823>
10 DISTROFIAS Musculares tipo Duchenne (DMD) e tipo Becker (DMB). Genoma.ib.usp.br. Disponível em: <https://genoma.ib.usp.br/pt-br/servicos/consultas-e-testes-geneticos/doencas-atendidas/distrofias-musculares-tipo-duchenne-dmd-e-tipo-becker-dmb>. Acesso em: 02, dez. 2020.
11 BORGES-OSÓRIO, Maria Regina & ROBINSON, Wanyce Miriam. GENÉTICA HUMANA. 2. ed. Porto Alegre, Artmed, 2001. 174 p.
12 DISTROFIA muscular de Becker. Distrofiabrasil.org.br, c2020. Dísponível em: <http://www.distrofiabrasil.org.br/becker>. Acesso em: 02, dez. 2020.
13 DISTROFIA muscular de Duchenne. Distrofiabrasil.org.br, c2020. Dísponível em: <http://www.distrofiabrasil.org.br/duchenne>. Acesso em: 02, dez. 2020.
14 MELO, A. P. F.; DE CARVALHO, F. A. Efeitos da fisioterapia respiratória na Distrofia Muscular de Duchenne. Revista Neurociências, 2001. Disponível em: <http://dx.doi.org/10.34024/rnc.2011.v19.8334>. Acesso em: 02, dez. 2020
15 NASCIMENTO, L. P., Andrade, A. L. M. de, Faria, T. C. C. de, Souza, L. de, Rocha, C. B. J., Carvalho, S. M. R. de, & Borges, J. B. C. (2015). Treinamento muscular respiratório em Distrofia Muscular de Duchenne. Revista Neurociências, 23(1), 9-15. https://doi.org/10.34024/rnc.2015.v23.8047
Figura 1- Acervo do autor, 2021
Figura 2- DUCHENNE, Guillaume-Benjamin. Desenho do menino com distrofia muscular de Duchenne. 1868. In: WIKIMEDIA COMMONS, a midiateca livre. 18 mai. 2020. Disponível em: <https://commons.wikimedia.org/w/index.php?title=File: Drawing_of_boy_with_Duchenne_muscular_dystrophy.png & oldid=42005553> sob CC BY-SA 3.0 . Acesso em: 5 jan. 2021.
Figura 3- GOWERS, William Richard. Gower 's sign.png. 1879. In: WIKIMEDIA COMMONS, a midiateca livre. 3 de novembro de 2020. Disponível em: <https://commons.wikimedia.org/w/index.php?title=File:Gower% 27s_Sign.png & oldid=509702015> sob CC BY-SA 3.0. Acesso em: 5 jan. 2021.
Figura 4: GENOME DECORATION PAGE/NCBI. DMD location.png. In: WIKIMEDIA COMMONS, a midiateca livre. 19 jul. 2017. Disponível em: <https://commons.wikimedia.org/wiki/File:DMD_gene_location.png> sob CC BY-SA 3.0. Acesso em 4 jan. 2021.
Figura 5: NATIONAL INSTITUTES OF HEALTH. X-linked recessive.svg. 2010. In: WIKIMEDIA COMMONS, a midiateca livre. Editado por Henrique Jábali. Disponível em: < https://commons.wikimedia.org/w/index.php?title=File:X-linked_recessive.svg&oldid=524483539> sob CC BY-SA 3.0. Acesso em 4 jan. 2021.
Tabela 1- Acervo do autor, 2021
